Как измениться ph при разбавлении водой
Кислоты глубоко вовлечены в бесчисленные биологические, геологические и технологические процессы. Бактерии производят молочную кислоту, которая сохраняет пищу, почвенные кислоты выделяют питательные вещества из минеральных удобрений, а кислоты в батареях приводят к реакциям, которые генерируют электрическую энергию. Соляная кислота, часто сокращенно называемая HCl, является распространенным примером сильной кислоты, и конкретные значения рН могут быть достигнуты с помощью смесей соляной кислоты и воды.
Измерение кислотности
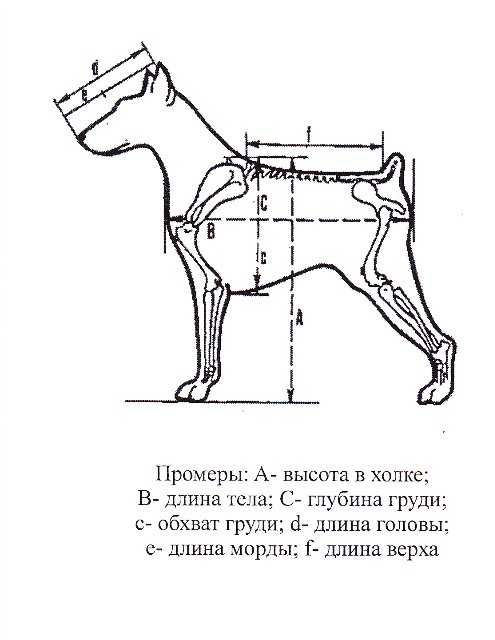
Шкала рН, которая обычно колеблется от 0 до 14, измеряет концентрацию ионов водорода в веществе. Кислоты имеют значения рН менее 7, основания имеют значения рН более 7, а значение рН 7,0 является нейтральной точкой. Шкала рН является отрицательной и логарифмической, что означает, что увеличение концентрации ионов водорода в 10 раз соответствует уменьшению на одну единицу шкалы рН. Добавление кислого вещества в воду снижает общий pH раствора.
Сломанные молекулы, свободные ионы
Когда кислоту добавляют в воду, молекулы кислоты разделяются на отдельные ионы в процессе, известном как диссоциация. Например, молекула соляной кислоты состоит из атома водорода и атома хлора. Когда эти молекулы растворяются в воде, они разделяются на положительно заряженный ион водорода и отрицательно заряженный ион хлора. Это приводит к увеличению концентрации ионов водорода и, следовательно, к снижению рН. Соляная кислота классифицируется как «сильная» кислота, что означает, что практически все молекулы диссоциируют. Многие другие кислоты, такие как уксусная кислота, обычно называемая уксусом, классифицируются как «слабые» кислоты. Лишь некоторые молекулы слабых кислот диссоциируют при добавлении в воду.
Экстремальная кислота
Чистая соляная кислота имеет теоретический pH, равный нулю, иными словами, она чрезвычайно кислая. Однако в практических ситуациях соляная кислота существует только в виде разбавленного вещества. Следовательно, эффективный рН соляной кислоты зависит от степени разбавления. Поскольку pH соляной кислоты настолько низок, большие изменения pH происходят, даже когда к нейтральному раствору, такому как вода, добавляются крошечные количества. Одним из примеров разбавленной соляной кислоты является желудочная кислота человека, которая имеет значение рН около 3.
Прогнозирование pH
Степень изменения pH, возникающая при добавлении в воду сильных кислот, таких как соляная кислота, соответствует коэффициенту разбавления, поскольку все кислые молекулы выделяют один ион водорода. Поскольку шкала рН соответствует логарифмическому соотношению, разведение с коэффициентом 10 соответствует изменению рН на одну единицу. Например, 1 миллилитр соляной кислоты, добавляемой к 10 миллилитрам pH-нейтральной воды, приводит к снижению концентрации ионов водорода на один коэффициент в десять раз. Таким образом, pH конечного раствора будет на одну единицу выше, чем pH исходной соляной кислоты. Если добавить 1 миллилитр соляной кислоты к 100 миллилитрам воды, концентрация ионов водорода уменьшается в два раза по десять, а рН увеличивается на две единицы.
Источник
Что можно использовать
Чтобы Ваши питомцы не ощутили на себе что-то из вышеперечисленного, необходимо снабдить их качественным источником кальция.
Подходящими являются вещества, содержащие примерно около 75% CaCO3.
Другие вещества, например, MgCO3, витамины и минералы – железо, фолиевая кислота, фосфор, не причинят вреда моллюскам, а вот меди стоит избегать, поскольку она очень токсична даже в небольшом количестве.
Источником кальция для улиток могут быть:
- Ракушечник (известняк);
- доломитовая мука;
- природный мел;
- сепия (панцирь каракатицы);
- скорлупа яиц;
- раковины других моллюсков.
Практически все эти продукты можно приобрести в зоомагазинах
При покупке обязательно обращайте внимание на состав, в котором не должна присутствовать соль
Некоторые владельцы моллюсков используют трикальцийфосфат. Только эту подкормку необходимо скармливать в смеси с другим источником кальция из перечисленных выше. В чистом виде скармливать не рекомендуется.

Сепию и природный мел можно не измельчать, а просто положить в террариум, улитки легко их обгрызают. А вот остальные виды нужно перемалывать до порошкообразного состояния, смешать в любых пропорциях и скармливать улиткам или же давать по отдельности.
Если Ваши взрослые улитки периодически откладывают яйца, а Вы уже не знаете, что с ними делать, то не спешите их выбрасывать. Сушеные яйца улиток – это замечательная кальциевая подкормка для новорожденных улитят и ослабленных особей.
Маленькие особи, как известно, после рождения съедают свои скорлупки. А через 2-3 дня им уже можно предлагать кальцесмесь или посыпая ей растительную пищу или же смешивая с водой и размазывая по стенкам террариума.
Зачем нужен?
Улитки в естественной среде обитания, как правило, сами о себе заботятся, получая кальций из природных источников. Данный элемент необходим им для правильного развития раковины, которая состоит из кальция и конхиолина. Когда животное растет, его железы выделяют вещества для строительства раковины, и она становится крепче и тверже. Моллюск, получая кальций, запускает процесс его переработки и наращивает раковину. Причем данный элемент улитка потребляет не только из пищи, но и благодаря своей подошве.
Если кальция в организме моллюска не хватает, происходит следующее:
- раковина становится тусклой и ломкой;
- улитка перестает расти;
- моллюск может начать прогрызать раковины своих собратьев;
- если раковина повреждена, процесс ее восстановления будет очень длительным;
- улитке трудно или практически невозможно отложить яйца.

Последствия закисления организма
Если алкалоз – менее распространенная форма кислотно-щелочного дисбаланса, то ацидоз встречается довольно часто. Одним из первых признаком закисленности организма являются темные круги под глазами. Кроме того, возможны частые головные боли, расстройство пищеварения, прыщи и гнойнички, склонность к простудам, головокружение, тошнота, горечь или кислый привкус во рту, налет на языке, физическая слабость.
Избыток кислоты в организме может стать причиной разных проблем со здоровьем:
- со стороны желудочно-кишечного тракта это острое или хроническое воспаление слизистой оболочки желудка, кишечный микоз, запор, проблемы с пищеварением, вздутие живота, заболевания желчного пузыря;
- со стороны мышц и суставов – подагра, мышечные боли, повреждение межпозвонковых дисков, острые и хронические боли в спине, остеопороз, артрит, ревматоидные заболевания;
- выпадение волос, ломкость ногтей, разрушение зубов, пародонтоз, сухость кожи, грибковые инфекции, прыщи, проблемы с кожей, целлюлит;
- со стороны метаболической системы это избыточный вес, внезапная потребность сладкого, сахарный диабет, камни в почках, повышенный уровень холестерина;
- со стороны сердечно-сосудистой системы это гипертония, заболевания кровеносных сосудов, нарушение кровоснабжения рук и ног, вызывающие ощущение холода в конечностях, головокружение, мигрень, инфаркт миокарда;
- хронические боли, депрессия, снижение работоспособности, общее недомогание, неспособность справиться со стрессом, снижение либидо, быстрая утомляемость.
Влияние pH, щелочности и жесткости на токсичность аммония и металлов
Аммоний становится более токсичным при возрастании pH. Высокие концентрации токсичной неионизированной формы аммония (NH3) формируются в основной воде, тогда как NH4+ преобладает в кислой воде. Так как щелочность повышается с ростом pH, аммоний становится более ядовитым в воде с высокой общей щелочностью. Жесткость обычно не связана с токсичностью аммония.
Металлы, такие как медь и цинк, более распространены в быту (в бассейнах, сантехнике и CuSO4). Они становятся лучше растворяются в кислой воде. Растворимость или свободная ионизированная форма этих металлов токсична для рыб. Высокая общая щелочность повышает pH и доступность оснований, которые способствуют образованию менее токсичных нерастворимых форм меди и цинка. Высокие концентрации кальция и магния (жесткость) блокируют эффекты меди и цинка в местах их токсического влияния. Поэтому, эти металлы более ядовиты для рыб в мягкой, кислой воде с низкой общей щелочностью.
В идеале, пруд с аквакультурой должен иметь pH 6.5-9.0, умеренную или высокую щелочность (75-200 мг/л, но не менее 20 мг/л) и кальциевую карбонатную жесткость 100-200 мг/л CaCO3. Многие принципы химизма абстрактны (буферизация, карбонатный-бикарбонатный) и их сложно понять. Но фундаментальное понимание взаимосвязи pH, CO2, щелочности и жесткости необходимо для эффективного управления аквакультурой.
——
www2.ca.uky.edu/wkrec/interactionsphetc.pdf
William A. Wurts and Robert M. Durborow. Interactions of pH, Carbon Dioxide, Alkalinity and Hardness in Fish Ponds. Southern Regional Aquaculture Center. SRAC Publication No. 464. 2012.
Обслуживание кальциевого реактора
Кальциевый реактор требует минимального обслуживания: так как насыщение воды кальцием и карбонатами происходит автоматически на протяжении продолжительного времени.
Очищенная аквариумная вода попадая внутрь кальциевого реактора подкисляется с помощью СО2 до тех пор, пока наполнитель не начинает растворяться.
В зависимости от конструкции кальциевого реактора углекислый газ может попадать в аквариум, создавая благоприятные условия для роста нитевидных водорослей, особенно когда вода имеет повышенное содержание фосфатов. Избежать этого можно нейтрализовав СО2 на выходе реактора, пропустив воду через дополнительную емкость с кальциевым наполнителем, или через специальный отсек с водорослями, где углекислота будет переработана растениями процессе фотосинтеза.
Важно установить низкую скорость потока через кальциевый реактор, так как с увеличением скорости количество углекислоты попадающей в аквариум увеличивается
Для большинства реакторов объем протекающей воды составляет 2-3 капли в секунду, тем не менее, стоит обратить внимание на технические характеристики конкретного устройства
Эффективность кальциевого реактора можно проверить, измерив значение карбонатной жесткости на выходе. Тем самым можно косвенно определить количество кальция, попадающего в воду.
Однако действительное значение карбонатной жесткости можно получить, отняв значение карбонатной жесткости аквариумной воды от значения карбонатной жесткости воды, на выходе кальциевого реактора.
Не следует допускать значений карбонатной жесткости в реакторе выше 16dKH, так как карбонатная жесткость в 20 и даже 30dKH может привести к тому, что часть растворенных в воде бикарбонатов при смешивании с аквариумной водой может снова выпасть в осадок. Да и в самом аквариуме не должно быть высокого значения карбонатной жесткости.
В естественных условиях ее значение находится около 7 dKH, этого вполне достаточно и для домашнего рифа.
В настоящее время еще нет доказательств того, что карбонатная жесткость имеющая значение более 7dKH может негативно сказаться состоянии гидробионтов, но Вернер Баллинг (Balling. 2002) заметил, что высокое содержание бикарбонатов в воде задерживает развитие жестких кораллов. И хотя эти данные официально не подтверждены, все же лучше поддерживать в морском аквариуме условия, близкие к естественным. А это означает, что карбонатная жесткость в 7dKH наиболее оптимальна.
Споры о том, какой наполнитель является лучшим для использования в кальциевых реакторах, идут до сих пор. Одни утверждают, что это коралловый песок, обосновывая это тем, что он якобы высвобождает действительно необходимые для кораллов минеральные вещества, так как в основной своей массе состоит из скелетов кораллов.
Другие убеждают в том, что лучше использовать чистый кальциевый гранулят, аргументируя это его чистотой и хорошей растворимостью. Оба наполнителя имеют как преимущества так и недостатки, поэтому каждый аквариумист должен полагаться на свои знания и опыт.
Возможно, в скором времени кто-либо из производителей начнет выпускать специальные, обогащенные наполнители для кальциевых реакторов, которые дополнительно будут содержать магний и некоторые другие важные минералы.
Необходимо учитывать и фракцию наполнителя, потому что сопротивление гранулята в пропускном направлении является важным параметром реакторов. В этой связи размер частиц гранулята должен выбираться, с ориентацией на данные производителя.
Примеры популярных кальциевых реакторов
Что такое щелочная вода
Не секрет, что человек состоит на 80% из воды, поэтому мы должны постоянно поддерживать ее концентрацию в организме, избегать обезвоживания. Для этого необходимо потреблять минимум 1,5 литра в сутки
Но важно не только количество, но и качество. Питьевая вода должна соответствовать всем нормам и ГОСТам, которые разработаны специально для того, чтобы на полках магазинов и из крана мы получали безопасную воду
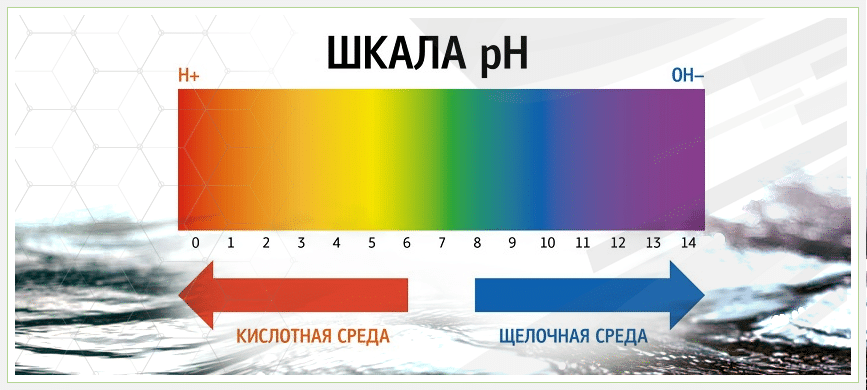
рН воды – это важный показатель. Всемирная организация здравоохранения строго определила данные относительно питьевой воды:
- pH
- pH 3-5 — кислые воды;
- pH 5-6,5 — слабокислые воды;
- pH 6,5-7,5 — нейтральная вода;
- pH 7,5-8,5 — слабощелочная вода;
- pH 8,5-9,5 — щелочная вода;
- pH>9,5 — сильнощелочная вода.
Нормальная питьевая вода находится в промежутке от 7 до 8. Таким образом нам подходят нейтральные или слабощелочные воды. В последнее время все больше ученых заявляют о пользе воды с щелочной средой. К примеру, японские ученые провели исследования, согласно которым вода с рН выше 6,5-7 увеличивает показатели продолжительности жизни населения фактически на 20-30%.
Многие путают понятия талая вода и щелочная. Первая имеет нейтральную рН, а в составе щелочной преобладают натрий, гидрокарбонатные ионы и магнезия, что смещает ее кислотность в щелочную сторону, а также придает ей иных свойств.
Исследование щелочности I: флора и фауна
В университете штата Мичиган изучали среду выращивания в парниках (в том числе, рН этой среды) и пришли к выводу, что чрезвычайно важно правильно подобрать рН среды еще до посадки
- Слишком высокий уровень рН (свыше 6,5) увеличивает шансы дефицита питательных микроэлементов.
- Слишком низкий уровень рН (менее 5,3) приводит к токсичности кальция и/или магния и/или марганца.
Консультативная служба университета штата Огайо сообщает, что щелочная вода влияет на способность растения получать питательные вещества из почвы, и со временем может изменить рН почвы.
По итогам экологического исследования, проведенного в Нидерландах, показало, что щелочная вода стала причиной гибели местного растения Stratiotes aloides L.
Рыба, подверженная постоянному воздействию щелочной мягкой воды, демонстрирует признаки стресса (иногда со смертельным исходом), в то время как рыба в щелочной жесткой воде не испытывает такого неблагоприятного воздействия, сообщается по итогам исследования, проведенного в университете Британской Колумбии.
Если у вас есть сад, то вы можете увидеть полезную иллюстрацию экологических последствий рН прямо там.
Если уровень рН низкий, гортензии будут цвести розовым цветом, а если высокий – синим.
Но как насчет нас, двуногих?
Циркуляция воды
Передвижение воды в емкости чрезвычайно важно для нормальной жизнедеятельности беспозвоночных, водорослей, кораллов и других обитателей, которые без циркуляции воды не могут прожить. Благодаря этому процессу происходит поступление пищи, кислорода, отвод ядовитых элементов

Помпа течения обеспечивает движение воды в аквариуме.
Обеспечить этот процесс можно посредством использования помпы течения. По принципу функционирования их можно условно подразделить на такие виды:
- С постоянным потоком. Обеспечивают бесперебойную циркуляцию воды.
- Оснащенные блоком управления. Обладают способностью регуляции силы тока жидкости, что приводит к формированию завихрений.
- С системой волн. Способствует образованию волн, создавая привлекательный зрительный эффект.
На протяжении часа движение воды должно составлять не меньше 3 частей объема всей воды. Организация комфортных условий для проживания обитателей без использования циркуляционных помп невозможно.
Жесткость
Жесткость является важным показателем воды при культивировании рыб. В гидрохимическом анализе он обычно присутствует. Жесткость определяется по концентрации двухвалентных ионов — кальцием, магнием и/или железом. Она может включать смесь двухвалентных солей, но кальций и магний всегда преобладают.
Традиционно, жесткость измеряется в ходе химического титрования. Жесткость образцов воды выражается в миллиграммах на литр в эквиваленте карбоната кальция (мг/л CaCO3). Кальциевая карбонатная жесткость основной индикатор количества двухвалентных солей, который не проводит различий между кальцием, магнием и солями других двухвалентных элементов.
Часто жесткость путают с щелочностью (общая концентрация оснований). Путаница возникает из-за того, что оба параметра измеряются в мг/л эквивалента CaCO3. Если известняк ответственен за оба параметра, жесткость и щелочность, их концентрация будет схожей. Однако, если в растворе, где на щелочность влияет NaHCO3, жесткость будет низкой, а щелочность, напротив, высокой. Кислые, подземные и колодезные воды могут иметь низкую или высокую жесткость и очень низкую щелочность (либо вообще не иметь её).
Кальций и магний важны для протекания ряда биологических процессов в организме рыб (формирование костей и чешуи, свертывании крови и других метаболических реакциях). Рыбы способны абсорбировать кальций и магний непосредственно из воды или с кормом.
Кальций наиболее важный двухвалентный элемент в культуральной воде. Присутствие свободного (ион) кальция в воде помогает снизить потери других солей (т.е. натрия и калия) из внутренних жидкостей рыб (крови). Натрий и калий входят в состав крови рыб. Они участвуют в реализации ряда процессов, в том числе, деятельности сердца, иннервации и мышечной деятельности. Исследования показали, что кальций окружающей среды также требуется для ре-абсорбции потерянных солей натрия и калия. В воде с низкой концентрацией кальция моет наблюдаться утечка значительных количеств натрия и калия в воду. Для вторичного впитывания этих элементов затрачивается энергия тела
Для некоторых видов рыб (Sciaenops ocellatus, Morone saxatilis) для выживания важно высокое значение кальциевой жесткости
Рекомендуемый диапазон свободного кальция в культуральной воде составляет 25-100 мг/л (65-250 мг/л CaCO3). Канальный сом толерантен к низкой концентрации кальция до тех пор, пока его корм содержит минимальный уровень кальция, однако скорость его роста низкая. Аналогично, радужная форель переносит низкие концентрации кальция (10 мг/л), если pH выше 6.5. Для выращивания Sciaenops ocellatus, Morone saxatilis или раков желательна концентрация свободного кальция 40-100 мг/л (100-250 мг/л CaCO3), что соответствует концентрации кальция в крови рыб (100 мг/л Ca или 250 мг/л CaCO3). Жесткость источников воды для этих видов должна быть проверена.
Низкая карбонатная жесткость надежный индикатор низкого содержания кальция. Однако высокая жесткость необязательно отражают высокую концентрацию этого элемента.
Карбонатная жесткость 100 мг/л включает 40 мг/л свободного кальция (делим CaCO3 на 2.5), в случае, если она обусловлена лишь присутствием кальция. Аналогично, если значение карбонатной жесткости 100 мг/л и представлена свободным магнием, концентрация магния составляет 24 мг/л (делим CaCO3 на 4.12). Эти факторы (2.5 и 4.12) связаны с молекулярной массой CaCO3 и различиями массы атомов магния и кальция. Там, где жесткость обусловлена присутствием известняка, значение CaCO3 обычно отражает смесь свободного кальция и магния. Но магния все равно преобладает в смеси.
Известняк может использоваться в сельском хозяйстве для повышения концентрации кальция (и карбонатной-бикарбонатной жесткости) в областях с кислой водой или почвой. Однако при pH 8.3 или выше известняк не растворяется. Мягкую, щелочную воду можно обогатить кальцием с помощью гипса (CaSO4) или CaCl2. Большие объемы обработки могут привести к серьезным расходам, и более практичным будет поиск другого источника воды.
Показания[ | ]
- Заболевания, сопровождающиеся гипокальциемией, повышением проницаемости клеточных мембран (в том числе сосудов), нарушением проведения нервных импульсов в мышечной ткани.
- Гипопаратиреоз (латентная тетания, остеопороз), нарушения обмена витамина D: рахит (спазмофилия, остеомаляция), гиперфосфатемия у больных ХПН.
- Повышенная потребность в Ca2+ (беременность, период лактации, период усиленного роста организма), недостаточное содержание Ca2+ в пище, нарушение его обмена (в постменопаузном периоде).
- Усиленное выведение Ca2+ (длительный постельный режим, хроническая диарея, вторичная гипокальциемия на фоне длительного приёма диуретиков и противоэпилептических ЛС, ГКС).
- Кровотечения различной этиологии; аллергические заболевания (сывороточная болезнь), крапивница, лихорадочный синдром, зуд, зудящие дерматозы, реакции на введение ЛС и приём пищевых продуктов, ангионевротический отёк; бронхиальная астма, дистрофические алиментарные отёки, лёгочный туберкулёз, свинцовые колики; эклампсия.
- Отравление солями Mg2+, щавелевой и плавиковой кислотами и их растворимыми солями (при взаимодействии с кальция глюконатом образуются нерастворимые и нетоксичные кальция оксалат и кальция фторид).
- Паренхиматозный гепатит, токсические поражения печени, нефриты, гиперкалиемическая форма пароксизмальной миоплегии.
Жесткость воды (dH)
Жесткость является одним из важнейших параметров пресной воды, от которой зависит возможность содержания и разведение в ней рыб и культивировании растений. Пресная или соленая вода из естественных водоемов содержит определенное количество ионов кальция(Ca2+), который представляет собой один из самых необходимых элементов для водных ракообразных и моллюсков, использующих его для построения панциря или раковины, а также для рыб, у которых он входит в состав костей. Вода содержит также ионы магния(Mg2+). Содержащиеся в воде ионы Ca2+ и Mg2+ обусловливают жесткость воды. Вместе они показывают общую жесткость воды. В зависимости от жесткости вода подразделяется на очень мягкую до 1,5 мг-экв/л (согласно принятой у нас системе стандартизации жесткость воды выражают в ммоль-эквивалентах ионов кальция или магния, содержащихся в 1 л воды. 1 моль-экв соответствует содержанию в воде 20,04 мг Ca2+ или 12,16 мг Mg 2+.) на мягкую 1,5-4 на средне жесткую 4-8 на жесткую 8-12 и на очень жесткую свыше 12. Жесткость водопроводов не должна превышать 7. Чтобы содержать и разводить аквариумных рыб, нужно поддерживать определенную жесткость воды. В аквариуме, где содержатся рыбы и моллюски, жесткость воды постепенно снижается: кальций расходуется на построение раковин моллюсков, он усваивается рыбами и растениями. В пустом аквариуме жесткость воды повышается вследствие постоянного испарения воды, а также при переходе кальция в воду из грунта. Для смягчения воды можно использовать такие растения, как роголистник и элодея. Для увеличения жесткости можно добавить в воду небольшие кусочки известняка, мела, мраморную крошку, ракушки, хлорид магния и кальция. Общая жесткость (dH — от англ. выражения «Degrees of Hardeness» — «градусы жесткости»)
Измерить уровень dH
В продаже имеются препараты, позволяющие быстро определить общую и временную жесткость(KH) воды. Для этого в бюретку наливают определенное инструкцией количество воды и капают в нее по каплям препарат, слегка покачивая бюретку после каждой капли. Количество капель, пошедшее на получение окраски воды, цвет которой указан в инструкции, соответствует градусам жесткости.
Количество значений состава воды велико и мы не будем подробно описывать все характеристики водной среды, но вы можете ознакомиться с таблицей, в которой обобщены все характеристики водной среды, подходящие для содержания многих видов аквариумных рыб.
Виды доступной вам воды
Очищенная вода – это вода, которая обработана физически, чтобы удалить примеси (например, с помощью дистилляции, деионизации, обратного осмоса, углеродной фильтрации и т.п.)
Дистиллированная вода – воду кипятят и выпаривают от растворенных минералов, а затем конденсируют испарения.
Бутилированная вода. Как правило, в бутылки разливают воду из родника или прошедшую процесс обратного осмоса. Тем не менее, некоторые бренды просто разливают в бутылки водопроводную воду, причем неизвестно, подвергалась ли она какой-либо дополнительной фильтрации.
Щелочная вода – это вода, разделенная на щелочные и кислотные фракции с помощью электролиза. При этом в индустрии питьевой воды используются естественные электрические заряды ионов кальция и магния.
Деионизированная или деминерализованная вода – это вода, из которой удалены ионы минералов (например, соли натрия, кальция, железа, меди, хлориды и бромиды) с помощью воздействия на нее электрически заряженных смол, которые притягивают и связывают соли.
Жесткая и мягкая вода: жесткая вода – это любая вода, содержащая заметное количество растворенных минералов; мягкая вода – это обработанная вода, в которой единственным катионом (положительно заряженным ионом) является натрий.
Понятие PH
Понятие кислотности или щелочности организма, или воды – основано на шкале рН.
Поэтому важно иметь базовое понимание того, что такое рН. pH – это просто мера концентрации ионов водорода
pH – это просто мера концентрации ионов водорода.
Сокращение «рН» означает «показатель водорода».
Чем выше рН жидкости, тем меньше в ней свободных ионов водорода; чем ниже рН, тем больше в ней свободных ионов водорода.
Одна единица рН отражает десятикратное изменение концентрации ионов – например, при рН 7 ионов водорода в десять раз больше, чем при рН 8.
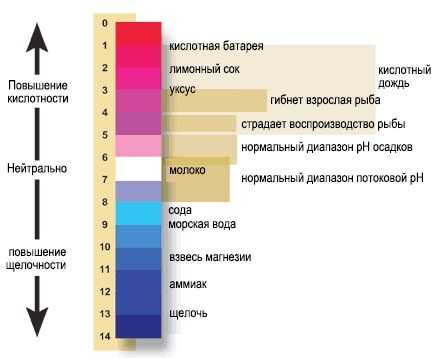
Диапазон значений шкалы рН – от 0 до 14, рН 7 – это нейтральное значение.
Все, что ниже рН 7, считается кислой средой (пример крайнего значения – кислотная батарея, рН 1).
Все, что выше рН 7, является щелочной средой (или базовой), а самым крайним значением в верхней части шкалы является щелочь – около 13.
рН воды в природе на нашей планете колеблется от 6,5 до 9,0, в зависимости от окружающей почвы и растительности, сезонных колебаний и погодных условий, и даже от времени суток с учетом солнечного света.
Человеческая деятельность тоже влияет на рН воды – шквалом токсичных промышленных загрязнителей.
Большинство водных животных и растений приспособлены к жизни в воде с очень специфическим уровнем рН – они умирают даже от незначительных изменений кислотности.
При уровне pH ниже 4 или свыше 10 гибнет почти вся рыба, и очень немногие животные способны выжить в воде с уровнем pH ниже 3 или свыше 11.
Если живые системы настолько чувствительны к изменениям рН, то неудивительно, что ВЫ, как и любой живой организм на этой планете, тоже чувствительны к рН воды.
Потенциальные полезные свойства
Хотя пить кислую воду не рекомендуется, наружное применение может оказывать некоторые полезные эффекты.
Может помочь при воспалительных заболеваниях кожи
Кислая вода, как известно, обладает сильным противомикробным действием. В частности, было выявлено, что она эффективна против золотистого стафилококка, который может вызывать и усугублять симптомы атопического дерматита (, , ).
Атопический дерматит – это хроническое воспалительное заболевание кожи, которое вызывает красные зудящие высыпания. Хотя исследования ограничены, наружное применение кислой воды может уменьшить покраснение и зуд кожи, связанные с атопическим дерматитом (, , ).
Одно исследование с участием 18 женщин с хроническим атопическим дерматитом показало, что купание в кислой воде было столь же эффективным в снижении тяжести симптомов атопического дерматита, как и стандартное лечение ().
Поскольку поверхность вашей кожи слегка кислая, было обнаружено, что повышение pH оказывает обезвоживающее и раздражающее действие на кожу. Исследования также показали, что некоторые воспалительные кожные заболевания, такие как экзема, часто сопровождаются повышением pH (, ).
В результате считается, что кислая вода может помочь поддерживать желаемый pH кожи, защищая от воспалительных заболеваний кожи и сохраняя увлажненность кожи ().
Одно исследование с участием 10 здоровых женщин показало, что нанесение кислой водно-масляной эмульсии после мытья водопроводной водой и мылом помогает поддерживать желаемый уровень pH на поверхности кожи ().
Хотя это исследование предполагает, что средства по уходу за кожей на основе кислой воды могут помочь защитить кожу от воспалительных состояний кожи, связанных с повышением pH, необходимы дополнительные исследования их долгосрочной эффективности.
Может помочь поддерживать оптимальный рН ваших волос и кожи головы
Поскольку ваши волосы и кожа головы также имеют более кислый уровень pH, считается, что кислая вода полезна для здоровья волос, включая предотвращение выпадения волос и уменьшение перхоти.
Одно исследование с участием 184 женщин показало, что присутствие эпидермального стафилококка и малассезии на коже головы в значительной степени связано с перхотью ().
Поскольку было доказано, что кислая вода обладает сильным противомикробным действием, она может помочь в лечении перхоти. Однако исследования не подтвердили ее эффективность.
Точно так же, хотя исследования показали, что шампуни с pH выше 5,5 могут увеличивать трение и вызывать ломкость волос, на сегодняшний день ни одно исследование не показало, что кислая вода предотвращает ломкость или выпадение волос ().
Другие возможные полезные свойства
В связи с антимикробным эффектом кислой воды некоторые люди рекомендуют мыть ею фрукты и овощи.
Кислая электролизованная вода – это кислая вода, полученная с использованием соляной кислоты. Хотя исследования ограничены, несколько исследований показали, что она безопасна и эффективна для уменьшения количества бактерий и других патогенов пищевого происхождения в свежих продуктах (, , ).
Однако неясно, являются ли другие источники кислой воды столь же безопасными и эффективными для мытья фруктов и овощей.
Кислая вода также считается лучшей для роста растений, а также для защиты от насекомых и вредителей.
Одно исследование на растениях томатов показало, что опрыскивание семян кислотной электролизованной водой значительно снижает количество бактериальных патогенов, не влияя на рост семян томата ().
Следовательно, орошение кислой водой может быть эффективным способом защиты растений от вредных патогенов. Тем не менее необходимы дополнительные исследования ее долгосрочного воздействия на различные виды растений.
Хотя многие растения предпочитают для роста слегка кислую почву, уровень pH 3,0 или ниже может ухудшить рост многих растений из-за снижения доступности питательных веществ и поглощения воды (, ).
В целом, прежде чем использовать кислую воду для ваших растений, важно определить оптимальный pH для вашего конкретного вида растений